Современные методы выявления злокачественных новообразований кожи, включая использование мобильных приложений и искусственного интеллекта: обзор литературы
12 августа 2024
Автор: Сиводедова Н.А., Карякин Н.Н., Шливко И.Л.
Злокачественные новообразования кожи (ЗНК) занимают одно из ведущих мест в структуре онкологических заболеваний мужского и женского населения в Российской Федерации [1]. В общей структуре заболеваемости злокачественными новообразованиями в России в 2021 г. у мужского населения ЗНК занимали 9,8%, с учетом меланомы кожи (МК) – 11,5%, у женского населения – 13,4%, c учетом МК – 15,5% [2].
Учитывая прогноз развития эпидемиологической ситуации, МК остается актуальной и глобальной проблемой, имеет жизненно важное значение для концентрации и укрепления глобальных усилий по профилактике онкозаболеваний. По оценкам, к 2040 г. глобальное бремя МК увеличится до 510 тыс. новых случаев и 96 тыс. смертей [3].
Для достижения целевых показателей федерального проекта «Борьба с онкологическими заболеваниями» национального проекта «Здравоохранение» актуальным остается увеличение охвата населения обследованиями, направленными на раннее выявление ЗНК, а также внедрение технологий, позволяющих сократить сроки от подозрения на ЗНК до постановки окончательного диагноза.
Цель данного обзора – провести поиск в достоверных научных базах статей по эффективности современных методов выявления ЗНК, включая использование мобильных приложений и ИИ.
На втором этапе вводили запросы по этим группам, получено 646 статей, исключали дубликаты и описание клинических кейсов. В итоге были отобраны статьи, в которых оценивалась чувствительность и специфичность. Были отобраны статьи, опубликованные за последние 5 лет. Были отобраны статьи, опубликованные за последние 5 лет (в случае, если в этот промежуток времени статьи по заданным тематикам не публиковались, в анализ включали статьи, опубликованные более 5 лет назад). В обзоре представлено 42 статьи по методам диагностики ЗНК.
Визуальные методы
Существуют различные диагностические алгоритмы визуальной диагностики: правило ABCDE, признак «гадкого утенка» (Ugly duckling sign), система Glasgow.
Правило АВСDE разработано R. Friedman(1985 г.): А – асимметрия родинки (одна половинка родинки не соответствует другой); В – неровность края (границы родинок неровные); С – различные цвета и оттенки; D – диаметр >6 мм; E – возвышение над уровнем кожи и/или любое изменение образования, произошедшее за последнее время (как минимум на протяжении 2 мес) [4]. Чувствительность метода – 83%, специфичность – 45% [5].
В 1994 г. клиническое правило ABCDE модифицировали. Критерий D в настоящем правиле соответствует определенным структурам пигментного новообразования, которые выявляются при проведении стандартной дерматоскопии. Данный алгоритм был разработан на основе статистического анализа 31 дермоскопического критерия, отобранного при исследовании 157 доброкачественных новообразований кожи (НК) и ЗНК. Каждый признак (асимметрия, границы новообразования, цвет, дермоскопические структуры) имеет определенное количество баллов, которое умножается на соответствующий коэффициент. При суммировании относительных единиц каждого признака определяется общее количество баллов (TDS – Total Dermoscopy Score). Если сумма относительных единиц превышает 5,45, точность диагностики меланомы составляет 92,2% [6]. Чувствительность и специфичность правила ABCDE при диагностике мелких меланом составили 47,3 и 56% [7].
В исследовании Л.В. Демидова и соавт. [8] оценивали достоверность разработанных дифференциально-диагностических признаков доброкачественных и злокачественных пигментных НК у 36 больных с 45 НК. Во всех случаях выполнено иссечение опухоли с лечебно-диагностической или косметической целью. Данные дерматоскопии сопоставлены с результатами гистологического исследования. В дальнейшем у 6 пациентов проводили динамическое наблюдение с предварительным картированием всех кожных покровов. МК оказались 9 из 45 пигментных образований, диспластическим невусом – 4, невусом – 25, доброкачественными НК – 7. При сопоставлении результатов анализа по правилу ABCD (ABCDE) и данных гистологического исследования установлено, что признаки МК выявлены в 90–100% случаев МК. Эти же признаки в 50–100% случаев выявлены при диспластических невусах и более чем в 50% случаев при невусах. Это свидетельствует о высокой частоте ложноположительных результатов при использовании правила ABCD (ABCDE).
Признак «гадкого утенка» (Ugly DucklingSign) – невус, который явно отличается от других у данного человека, также может улучшить обнаружение МК. В исследовании С. Gaudy-
Marqueste и соавт. [9] анализировали влияние признака «гадкого утенка» на диагностику МК из 2089 клинических изображений невусову 80 пациентов и 766 дерматоскопических
изображений. Среднее количество признака «гадкого утенка» на одного пациента составило 0,8 среди клинических изображений невусов и 1,26 среди дерматоскопических. Чувствительность метода – 85%, специфичность – 83% [10].
7-точечная система Glasgow, разработан-ная исследователями из Университета Glasgow (Шотландия) в 1989 г., включает изучение 7 признаков новообразования, причем 3 из них основные: 1) изменение размеров, объема; 2) изменение формы, очертаний; 3) изменение цвета, а также дополнительные: 4) воспаление; 5) образование корки или кровоточивости; 6) изменение ощущений, чувствительности; 7) диаметр >7 мм. По данным исследований, чувствительность метода составляет ~79,0% [8, 11].
Применение визуальных диагностических систем обладает достаточно высокой чувствительностью и ожидаемо низкой специфичностью при диагностике МК [6].
Подсчитано, что чувствительность клинической диагностики при визуальном осмотре опытным дерматологом составляет ~70% [12, 13].
Дерматоскопия
Это метод эпилюминесцентной микроскопии кожи при помощи оптического прибора – дерматоскопа позволяет получить изображение поверхностных и внутренних структур кожи. Роль дерматоскопии в клинической диагностике меланоцитарных и немеланоцитарных поражений хорошо известна и заключается в возможности дифференцировать доброкачественные НК и ЗНК [14].
По данным литературы, использование дерматоскопии повышает эффективность диагностики первичной МК от 5 до 30% по сравнению с визуальным клиническим осмотром [15]. Однако при использовании неподготовленными специалистами точность может быть не выше, чем при визуальном осмотре [16].
В работе Monika Słowińska и соавт. былов ключено 166 контрольных поражений, включая 85 крупных (>5 мм) МК и 81 клинически сомнительно меланоцитарных невусов размером ≤5 мм. Из 103 МК только 44 были МК in situ. 5 дерматоскопических предикторов МК были идентифицированы для оценки плоских меланоцитарных поражений размером ≤5 мм: атипичная пигментная сеть, бело-голубая вуаль, псевдоподии, наличие более одного цвета. Чувствительность метода варьирует от 78 до 90% при специфичности от 45 до 90% соответственно для неэкспертов и экспертов [13, 17, 18].
Ультразвуковая диагностика
В отечественной и зарубежной литературе имеются данные о применении ультразвуковых исследований (УЗИ) в неинвазивной диагностике МК. Работы по изучению сонографической визуализации доброкачественных пигментных образований и МК немногочисленны, а результаты исследований противоречивы [19]. УЗИ позволяют оценить размеры, форму, структуру, васкуляризацию, отсутствие или наличие инвазивного роста, оценить глубину инвазии меланоцинарных образований кожи и состояние прилежащих кожных покровов. Выявлены определенные сонографические отличия между доброкачественными и диспластическими (пограничными) невусами по результатам допплерографии. Наибольшая ценность сонографии установлена при узловых формах МК, параметры внутриопухолевой гемодинамики можно использовать для планирования тактики и объема операции, прогнозирования потенциала метастазирования.
Чувствительность УЗИ при дифференциальной диагностике меланоцитарных образований кожи варьирует от 83 до 100%, специфичность – от 33 до 93% [20, 21].
Отражательная конфокальная микроскопия
В последнее десятилетие было показано,что отражательная конфокальная микроскопия (ОКМ) в клинической практике в сочетании с дерматоскопией еще больше улучшает раннюю диагностику ЗНК [22]. ОКМ позволяет неинвазивно визуализировать эпидермис и сосочковую дерму. Поскольку меланин явля-тся сильным источником контраста для изображений, этот метод используется для изучения морфологии тканей нормальной кожи и меланоцитарных поражений на микроскопическом уровне [23].
Авторы показали, что не выявлено значительного улучшения чувствительности при сравнении комбинации дерматоскопии и ОКМ и только ОКМ (94,56 против 97,82%; р=0,043) [24]. Однако различия между показателями специфичности были статистически значимыми (p<0,000001), что отдавало предпочтение только ОКМ. Оценка злокачественного лентиго имеет чувствительность 85–93% и специфичность 76–82% при диагностике злокачественного лентиго и дифференциации от доброкачественного меланоза [25]. В ряде исследований сообщалось, что метод позволяет достичь чувствительности 70–92% и специфичности 84–88% для меланоцитарных поражений; чувствительности 92–100% и специфичности 85– 97% для немеланоцитарных поражений кожи. Было установлено, что визуализация значима для выявления беспигментных форм МК, достигая чувствительности до 85% и специфичности до 84% [26].
Общий снимок тела
(total-body photography, TBP)
Этот метод позволяет получать изображения всего тела и наблюдать пациентов с большим количеством меланоцитарных поражений, оценивать изменения на коже в динамике, повышая точность ранней диагностики для людей с высоким риском МК [27–29].
Развитием двухмерных (2D) устройств TBP стала технология 3D-TBP. С 2017 г. 3D-TBP предлагает дополнительные преимущества: экономия времени, поскольку все изображения захватываются одновременно в течение нескольких секунд [30]. Для автоматизации метода проводятся исследования по применению сверточных нейронных сетей [31, 32].
У пациентов с высоким риском развития МК число биопсий после использования ТВР уменьшилось в 3,8 раза [33].
2 опроса американских дерматологов продемонстрировали разные причины использования и противоречивые мнения об эффективности ТВР. Всего было получено 107 ответов. Почти 65% респондентов (69 из 107) сообщили об использовании ТВР [34]. В другом исследовании 59 (71,1%) сообщили об использовании ТВР, что на 11,9% больше за последнее десятилетие. Причины использования ТВР включали снижение беспокойства пациентов (81,4%), помощь в выявлении ранней МК (78,0%) и сокращение количества биопсий (66,1%) [35, 36]. Чувствительность и специфичность составляли 90,0 и 64,6% соответственно [37].
Методы, основанные на применении искусственного интеллекта
За последние годы произошел ряд значимых прорывов в области нейронных сетей. Полученные за последние десятилетия открытия в области нейробиологии [38], особенно работа по изучению зрительной коры кошек Д. Хьюбела и Т.Н. Визеля, за которую они получили Нобелевскую премию по физиологии и медицине 1981 г. [39], и дальнейшее развитие методов градиентного спуска [40] с ростом вычислительных возможностей компьютеров, а также использование современных графических процессоров (GPU) привело к значительному росту использования таких типов нейронных сетей, как «сети глубокого обучения» (DNN) [41] и «сверточные сети» (CNN) [42]. Применение этих методов позволило расширить возможности по компьютерному анализу изображений. Сверточные слои на основе определенной операции извлекают первичные признаки из изображения и передают их на слои линейного классификатора, используя методы «обучения с учителем» и «обратное распространение ошибки» [43] с «градиентным спуском». Коррекция весовых коэффициентов сверточных слоев и линейного классификатора на обучающих данных приводит к снижению ошибок сети, повышая возможности распознавания и классификации объектов по изображению. Вышеописанные подходы в данной области показывают хорошие результаты при анализе и классификации изображений невусов. В работе [44] предложенная расширенная архитектура сверточной сети CNN + IHHO показала следующие результаты: чувствительность – 96,1%, специфичность – 98,6%, точность – 97,3%. В других исследованиях различные варианты архитектур сверточных нейронных сетей показывают точность до 90–95% [45–49].
В исследовании [50] сравнили диагностическую эффективность ИИ с оценкой 58 дерматологов. Использовался тестовый набор из 100 изображений. На I уровне исследования дерматологам было представлено исключительно дерматоскопическое изображение, врачей попросили указать диагноз (меланома, доброкачественный невус) и их решение (удаление, наблюдение, удаление не требуется). После 4 нед те же участники указали свой диагноз и решение о лечении на II уровне, которое включало дерматоскопические изображения, дополненные дополнительной клинической информацией и изображениями крупным планом тех же 100 случаев. Основными показателями результатов были чувствительность, специфичность и площадь под кривой (AUC) для диагностической классификации поражений с помощью ИИ по сравнению с оценками дерматологов.
На I уровне дерматологи достигли средней чувствительности и специфичности для классификации поражений 86,6±9,3 и 71,3±11,2% соответственно. Больше клинической информации (уровень II) повысило чувствительность до 88,9±9,6% (p=0,19) и специфичность до 75,7%±11,7% (p<0,05). Кривая ROC у CNN показала более высокую специфичность 82,5% по сравнению с дерматологами на I (71,3%, p<0,01) и II уровне (75,7%, p<0,01) при их чувствительности 86,6 и 88,9% соответственно. CNN ROC AUC была больше средней площади ROC-кривой дерматологов (0,86 против 0,79, p<0,01). Независимо от опыта врачей большинство дерматологов уступило ИИ.
В исследовании авторов M.A. Marchetti и соавт. сравнивали эффективность компьютерных алгоритмов в диагностике МК со средней эффективностью 8 опытных дерматологов, использующих 100 дерматоскопических изображений пигментных поражений. В результате было обнаружено, что отдельные компьютерные алгоритмы имеют диагностическую точность, сравнимую с оценкой дерматологом: при чувствительности 82% средняя специфичность была аналогично лучшему компьютерному алгоритму [51].
Нейросеть показала высокую эффективность (чувствительность >93,3%, специфичность >65%) при злокачественных лентиго и узловых МК [52].
Использование мобильных приложений и телемедицинских технологий
Кроме непосредственного применения, вышеизложенные подходы и методы реализуются в телемедицинских технологиях в виде приложений для смартфонов, которые используются пациентами и медицинскими работниками: они могут направить пациента за медицинской помощью, а врачам помогают решить, следует ли направить пациента к онкологу.
Телемедицинские технологии – это информационные технологии, обеспечивающие дистанционное взаимодействие медицинских работников между собой, с пациентами и (или) их законными представителями, идентификацию и аутентификацию указанных лиц, документирование совершаемых ими действий при проведении консилиумов, консультаций, дистанционного медицинского наблюдения за состоянием здоровья пациента, согласно Федеральному закону Российской Федерации от 29.07.2017 № 242-ФЗ «О внесении изменений в отдельные законодательные акты Российской Федерации по вопросам применения информационных технологий в сфере охраны здоровья»1.
Мобильная теледерматоскопия получила положительную оценку в отношении как непосредственного взаимодействия с пациентами, так и взаимодействия между врачами [53].
В исследовании «Предпочтения потребителей в отношении скрининга рака кожи с помощью мобильной теледерматоскопии» было проведено интервью, посвященное поведению людей при скрининге. Тематический анализ был проведен двумя независимыми исследователями. Всего опрошено 28 участников. 86% участников ранее проходили обследование кожи, 18% посещали одного и того же врача для каждого осмотра кожи. В результате 27 участников (96,4%, n=27/28) предпочли бы использование мобильной теледермоскопии для мониторинга повреждений кожи между плановыми визитами к врачу и 1 участник (3,6%, n=1/28) ответил, что он не уверен [53].
В проведенном обзоре мобильных приложений для выявления ЗНК отмечается, что с 2014 г. наблюдается устойчивый рост числа приложений, доступных для первичной и вторичной профилактики ЗНК. Однако количество приложений с доказательной эффективностью увеличилось незначительно, что может приводить к опасениям пользователей относительно эффективности этих приложений. Для обеспечения безопасности пользователей мобильные приложения должны быть более надежными и общедоступными.
Поиск приложений для профилактики ЗНК проводился в двух крупных магазинах приложений для смартфонов (Android и iOS) в июне 2019 г. Были описаны количество, функциональность, рейтинги, цена приложений и проведено сравнение с аналогичными обзорами рынка приложений с 2014 по 2017 г. Поиск в июне 2019 г. выявил 66 приложений. Из 39 приложений, обнаруженных в 2014 г., 30 были недоступны в 2019 г., что составляет 77%; из 43 приложений, доступных в 2017 г., следовательно, количество доступных приложений за указанный период снизилось и составило 46,5%. В 2019 г. увеличилось количество приложений, которых можно было загрузить бесплатно, 63,6% (n=42/66) по сравнению с 53,5% (n=23/43) в 2017 г. Наиболее распространенной функциональностью приложения, предлагаемой в 2019 г., был мониторинг/отслеживание поражений – 48,5% (n=32/66). С 2014 г. наблюдается неуклонный рост числа приложений, доступных для широкой публики для поддержки профилактики или раннего выявления ЗНК. По-прежнему наблюдается высокая текучесть приложений, многим приложениям по-прежнему не хватает информации доказательств их безопасности и ценности [54]. Примеры мобильных приложений доступных в 2023 г. представлены в табл. 1.
В Германии была проведена оценка мобильного приложения SkinVision (№ 8) для диагностики МК. Чувствительность диагностики составляла 73,0%, специфичность – 83,0% по сравнению с чувствительностью 88,0% и специфичностью 97,0% клинического диагноза дерматологами. Минусом в работе приложения является ограниченно бесплатное использование [55].
В России разработан программный комплекс «ПроРодинки» (№ 10) для использования пациентами и специалистами. Приложение доступно на смартфонах и предназначено для анализа НК по фотографии, а также набора риск-факторов, предоставленных пользователем. Фотографии, сделанные пользователями, проходят контроль с помощью алгоритмов компьютерного зрения [56]. Алгоритм определяет наличие и размеры новообразования на полученном снимке. Анализ полученных снимков выполняется с применением ансамбля нейронных сетей, обученного на верифицированном банке изображений риск-факторов и на динамике новообразований.
В исследовании, опубликованном в 2023 г., было обработано с помощью ИИ и проверено экспертами-дерматологами более 400 тыс. изображений, присланных пользователями в сочетании с факторами риска и демографическими данными. Алгоритмами приложения выявлено 9321 ЗНК, в том числе 5230 МК [57].
Результаты использования телемедицинских технологий в виде интернет-платформы для дистанционных консультаций сельского населения были опубликованы в работе P. Sall N’diaye и соавт. [58]. Проведен осмотр кожи у 289 человек, у 199 (69%) заподозрены ЗНК. Фотографии поражений кожи были переданы 4 дерматовенерологам для дистанционной консультации. В результате у 105 (53%) пациентов подозрение на ЗНК не подтвердилось и последующих очных консультаций не потребовалось. 61 (31%) пациент направлен к дерматовенерологу для осмотра в плановом порядке. 17 (9%) пациентов направлены на прием в экстренном порядке. 16 (8%) пациентам рекомендовано динамическое
наблюдение и консультация дерматовенеролога через 12 мес. Впоследствии из 78 пациентов, которым требовалась очная консультация дерматовенеролога, у 12 человек была заподозрена МК (по результатам биопсии подтверждена 1 МК), у 10 пациентов заподозрены ЗНК (во всех случаях по результатам биопсии подтверждены доброкачественные образования).
Таким образом, использование телемедицинских технологий может снижать необходимость очных осмотров дерматовенерологом.
В другом исследовании было показано, что использование телемедицинских технологий сокращает срок постановки диагноза у пациента с меланомой (среднее время между получением направления и обращением к онкологу составляет 9 дней по сравнению с 26,5 днями при стандартной амбулаторной помощи) [59].
Преимущества мобильных приложений для диагностики ЗНК в виде ориентированности на пациента, ускорения визитов к врачу, доступности, экономии времени, возможности контроля НК отмечается и другими авторами [60]. Эти же авторы указывают на ограничения применения мобильных приложений при поражениях кожи в труднодоступных местах, кроме того, сохраняется недоверие пользователей к телемедицинским технологиям в виде использования мобильных приложений.
Наиболее широко используемый в клинической практике метод дерматоскопии требует соответствующей подготовки врачей, поскольку при использовании неподготовленными специалистами показывает точность не выше, чем при визуальном осмотре.
Из достижений последних лет можно отметить использование инструментов на основе ИИ. Исследования, построенные на анализе изображений ЗНК, показывают высокую чувствительность и специфичность (см. табл. 2). Полученные результаты могут внушать определенный оптимизм, но пока использование таких технологий в клинической практике относительно редко.
Использование мобильных приложений с применением нейронных сетей и приложений для самодиагностики пока находится в стадии поиска наиболее эффективных подходов, несмотря на то что в некоторых странах надзорные органы одобрили использование подобных решений в клинической практике, к тому же отмечается небольшое количество качественных исследований эффективности данных технологий. В определенных случаях использование приложений может приводить к росту расходов на здравоохранение [61].
1 Федеральный закон Российской Федерации от 29.07.2017 № 242-ФЗ «О внесении изменений в отдельные законодательные акты Российской Федерации по вопросам применения информационных технологий в сфере охраны здоровья».
СВЕДЕНИЯ ОБ АВТОРАХ
Сиводедова Наталья Антоновна (Natalia A. Sivodedova) – аспирант кафедры общественного здоровья и здравоохранения ФДПО, ФГБОУ ВО ПИМУ Минздрава России; врач-онколог, заведующий отделом телемедицины и информационных технологий, ГАУЗ НО НИИКО «Нижегородский областной клинический онкологический диспансер», Нижний Новгород, Российская Федерация
https://orcid.org/0000-0001-6815-328X
Карякин Николай Николаевич (Nikolay N. Karyakin) – доктор медицинских наук, доцент, ректор ФГБОУ ВО ПИМУ Минздрава России, Нижний Новгород, Российская Федерация
https://orcid.org/0000-0001-8958-6199
Шливко Ирена Леонидовна (Irena L. Shlivko) – доктор медицинских наук, заведующий кафедрой кожных и венерических болезней, ФГБОУ ВО ПИМУ Минздрава России, Нижний Новгород, Российская Федерация
https://orcid.org/0000-0001-7253-7091
Учитывая прогноз развития эпидемиологической ситуации, МК остается актуальной и глобальной проблемой, имеет жизненно важное значение для концентрации и укрепления глобальных усилий по профилактике онкозаболеваний. По оценкам, к 2040 г. глобальное бремя МК увеличится до 510 тыс. новых случаев и 96 тыс. смертей [3].
Для достижения целевых показателей федерального проекта «Борьба с онкологическими заболеваниями» национального проекта «Здравоохранение» актуальным остается увеличение охвата населения обследованиями, направленными на раннее выявление ЗНК, а также внедрение технологий, позволяющих сократить сроки от подозрения на ЗНК до постановки окончательного диагноза.
Цель данного обзора – провести поиск в достоверных научных базах статей по эффективности современных методов выявления ЗНК, включая использование мобильных приложений и ИИ.
Материал и методы
Для поиска источников литературы были использованы базы данных PubMed (Medline), CyberLeninka, РИНЦ среди англо- и русскоязычных публикаций. В исследовании применялась тематическая и смысловая методология получения информации. В поисковой строке вводили запросы по следующим ключевым словам: кожа, злокачественные новообразования кожи, меланома, базальноклеточный рак кожи, мобильные приложения, телемедицинские технологии. На первом этапе были найдены 1304 статьи на тему современных методов диагностики, из полученных статей были выделены следующие категории: визуальные методы, инструментальные и методы с применением информационных технологий.На втором этапе вводили запросы по этим группам, получено 646 статей, исключали дубликаты и описание клинических кейсов. В итоге были отобраны статьи, в которых оценивалась чувствительность и специфичность. Были отобраны статьи, опубликованные за последние 5 лет. Были отобраны статьи, опубликованные за последние 5 лет (в случае, если в этот промежуток времени статьи по заданным тематикам не публиковались, в анализ включали статьи, опубликованные более 5 лет назад). В обзоре представлено 42 статьи по методам диагностики ЗНК.
Визуальные методы
Существуют различные диагностические алгоритмы визуальной диагностики: правило ABCDE, признак «гадкого утенка» (Ugly duckling sign), система Glasgow.
Правило АВСDE разработано R. Friedman(1985 г.): А – асимметрия родинки (одна половинка родинки не соответствует другой); В – неровность края (границы родинок неровные); С – различные цвета и оттенки; D – диаметр >6 мм; E – возвышение над уровнем кожи и/или любое изменение образования, произошедшее за последнее время (как минимум на протяжении 2 мес) [4]. Чувствительность метода – 83%, специфичность – 45% [5].
В 1994 г. клиническое правило ABCDE модифицировали. Критерий D в настоящем правиле соответствует определенным структурам пигментного новообразования, которые выявляются при проведении стандартной дерматоскопии. Данный алгоритм был разработан на основе статистического анализа 31 дермоскопического критерия, отобранного при исследовании 157 доброкачественных новообразований кожи (НК) и ЗНК. Каждый признак (асимметрия, границы новообразования, цвет, дермоскопические структуры) имеет определенное количество баллов, которое умножается на соответствующий коэффициент. При суммировании относительных единиц каждого признака определяется общее количество баллов (TDS – Total Dermoscopy Score). Если сумма относительных единиц превышает 5,45, точность диагностики меланомы составляет 92,2% [6]. Чувствительность и специфичность правила ABCDE при диагностике мелких меланом составили 47,3 и 56% [7].
В исследовании Л.В. Демидова и соавт. [8] оценивали достоверность разработанных дифференциально-диагностических признаков доброкачественных и злокачественных пигментных НК у 36 больных с 45 НК. Во всех случаях выполнено иссечение опухоли с лечебно-диагностической или косметической целью. Данные дерматоскопии сопоставлены с результатами гистологического исследования. В дальнейшем у 6 пациентов проводили динамическое наблюдение с предварительным картированием всех кожных покровов. МК оказались 9 из 45 пигментных образований, диспластическим невусом – 4, невусом – 25, доброкачественными НК – 7. При сопоставлении результатов анализа по правилу ABCD (ABCDE) и данных гистологического исследования установлено, что признаки МК выявлены в 90–100% случаев МК. Эти же признаки в 50–100% случаев выявлены при диспластических невусах и более чем в 50% случаев при невусах. Это свидетельствует о высокой частоте ложноположительных результатов при использовании правила ABCD (ABCDE).
Признак «гадкого утенка» (Ugly DucklingSign) – невус, который явно отличается от других у данного человека, также может улучшить обнаружение МК. В исследовании С. Gaudy-
Marqueste и соавт. [9] анализировали влияние признака «гадкого утенка» на диагностику МК из 2089 клинических изображений невусову 80 пациентов и 766 дерматоскопических
изображений. Среднее количество признака «гадкого утенка» на одного пациента составило 0,8 среди клинических изображений невусов и 1,26 среди дерматоскопических. Чувствительность метода – 85%, специфичность – 83% [10].
7-точечная система Glasgow, разработан-ная исследователями из Университета Glasgow (Шотландия) в 1989 г., включает изучение 7 признаков новообразования, причем 3 из них основные: 1) изменение размеров, объема; 2) изменение формы, очертаний; 3) изменение цвета, а также дополнительные: 4) воспаление; 5) образование корки или кровоточивости; 6) изменение ощущений, чувствительности; 7) диаметр >7 мм. По данным исследований, чувствительность метода составляет ~79,0% [8, 11].
Применение визуальных диагностических систем обладает достаточно высокой чувствительностью и ожидаемо низкой специфичностью при диагностике МК [6].
Подсчитано, что чувствительность клинической диагностики при визуальном осмотре опытным дерматологом составляет ~70% [12, 13].
Дерматоскопия
Это метод эпилюминесцентной микроскопии кожи при помощи оптического прибора – дерматоскопа позволяет получить изображение поверхностных и внутренних структур кожи. Роль дерматоскопии в клинической диагностике меланоцитарных и немеланоцитарных поражений хорошо известна и заключается в возможности дифференцировать доброкачественные НК и ЗНК [14].
По данным литературы, использование дерматоскопии повышает эффективность диагностики первичной МК от 5 до 30% по сравнению с визуальным клиническим осмотром [15]. Однако при использовании неподготовленными специалистами точность может быть не выше, чем при визуальном осмотре [16].
В работе Monika Słowińska и соавт. былов ключено 166 контрольных поражений, включая 85 крупных (>5 мм) МК и 81 клинически сомнительно меланоцитарных невусов размером ≤5 мм. Из 103 МК только 44 были МК in situ. 5 дерматоскопических предикторов МК были идентифицированы для оценки плоских меланоцитарных поражений размером ≤5 мм: атипичная пигментная сеть, бело-голубая вуаль, псевдоподии, наличие более одного цвета. Чувствительность метода варьирует от 78 до 90% при специфичности от 45 до 90% соответственно для неэкспертов и экспертов [13, 17, 18].
Ультразвуковая диагностика
В отечественной и зарубежной литературе имеются данные о применении ультразвуковых исследований (УЗИ) в неинвазивной диагностике МК. Работы по изучению сонографической визуализации доброкачественных пигментных образований и МК немногочисленны, а результаты исследований противоречивы [19]. УЗИ позволяют оценить размеры, форму, структуру, васкуляризацию, отсутствие или наличие инвазивного роста, оценить глубину инвазии меланоцинарных образований кожи и состояние прилежащих кожных покровов. Выявлены определенные сонографические отличия между доброкачественными и диспластическими (пограничными) невусами по результатам допплерографии. Наибольшая ценность сонографии установлена при узловых формах МК, параметры внутриопухолевой гемодинамики можно использовать для планирования тактики и объема операции, прогнозирования потенциала метастазирования.
Чувствительность УЗИ при дифференциальной диагностике меланоцитарных образований кожи варьирует от 83 до 100%, специфичность – от 33 до 93% [20, 21].
Отражательная конфокальная микроскопия
В последнее десятилетие было показано,что отражательная конфокальная микроскопия (ОКМ) в клинической практике в сочетании с дерматоскопией еще больше улучшает раннюю диагностику ЗНК [22]. ОКМ позволяет неинвазивно визуализировать эпидермис и сосочковую дерму. Поскольку меланин явля-тся сильным источником контраста для изображений, этот метод используется для изучения морфологии тканей нормальной кожи и меланоцитарных поражений на микроскопическом уровне [23].
Авторы показали, что не выявлено значительного улучшения чувствительности при сравнении комбинации дерматоскопии и ОКМ и только ОКМ (94,56 против 97,82%; р=0,043) [24]. Однако различия между показателями специфичности были статистически значимыми (p<0,000001), что отдавало предпочтение только ОКМ. Оценка злокачественного лентиго имеет чувствительность 85–93% и специфичность 76–82% при диагностике злокачественного лентиго и дифференциации от доброкачественного меланоза [25]. В ряде исследований сообщалось, что метод позволяет достичь чувствительности 70–92% и специфичности 84–88% для меланоцитарных поражений; чувствительности 92–100% и специфичности 85– 97% для немеланоцитарных поражений кожи. Было установлено, что визуализация значима для выявления беспигментных форм МК, достигая чувствительности до 85% и специфичности до 84% [26].
Общий снимок тела
(total-body photography, TBP)
Этот метод позволяет получать изображения всего тела и наблюдать пациентов с большим количеством меланоцитарных поражений, оценивать изменения на коже в динамике, повышая точность ранней диагностики для людей с высоким риском МК [27–29].
Развитием двухмерных (2D) устройств TBP стала технология 3D-TBP. С 2017 г. 3D-TBP предлагает дополнительные преимущества: экономия времени, поскольку все изображения захватываются одновременно в течение нескольких секунд [30]. Для автоматизации метода проводятся исследования по применению сверточных нейронных сетей [31, 32].
У пациентов с высоким риском развития МК число биопсий после использования ТВР уменьшилось в 3,8 раза [33].
2 опроса американских дерматологов продемонстрировали разные причины использования и противоречивые мнения об эффективности ТВР. Всего было получено 107 ответов. Почти 65% респондентов (69 из 107) сообщили об использовании ТВР [34]. В другом исследовании 59 (71,1%) сообщили об использовании ТВР, что на 11,9% больше за последнее десятилетие. Причины использования ТВР включали снижение беспокойства пациентов (81,4%), помощь в выявлении ранней МК (78,0%) и сокращение количества биопсий (66,1%) [35, 36]. Чувствительность и специфичность составляли 90,0 и 64,6% соответственно [37].
Методы, основанные на применении искусственного интеллекта
За последние годы произошел ряд значимых прорывов в области нейронных сетей. Полученные за последние десятилетия открытия в области нейробиологии [38], особенно работа по изучению зрительной коры кошек Д. Хьюбела и Т.Н. Визеля, за которую они получили Нобелевскую премию по физиологии и медицине 1981 г. [39], и дальнейшее развитие методов градиентного спуска [40] с ростом вычислительных возможностей компьютеров, а также использование современных графических процессоров (GPU) привело к значительному росту использования таких типов нейронных сетей, как «сети глубокого обучения» (DNN) [41] и «сверточные сети» (CNN) [42]. Применение этих методов позволило расширить возможности по компьютерному анализу изображений. Сверточные слои на основе определенной операции извлекают первичные признаки из изображения и передают их на слои линейного классификатора, используя методы «обучения с учителем» и «обратное распространение ошибки» [43] с «градиентным спуском». Коррекция весовых коэффициентов сверточных слоев и линейного классификатора на обучающих данных приводит к снижению ошибок сети, повышая возможности распознавания и классификации объектов по изображению. Вышеописанные подходы в данной области показывают хорошие результаты при анализе и классификации изображений невусов. В работе [44] предложенная расширенная архитектура сверточной сети CNN + IHHO показала следующие результаты: чувствительность – 96,1%, специфичность – 98,6%, точность – 97,3%. В других исследованиях различные варианты архитектур сверточных нейронных сетей показывают точность до 90–95% [45–49].
В исследовании [50] сравнили диагностическую эффективность ИИ с оценкой 58 дерматологов. Использовался тестовый набор из 100 изображений. На I уровне исследования дерматологам было представлено исключительно дерматоскопическое изображение, врачей попросили указать диагноз (меланома, доброкачественный невус) и их решение (удаление, наблюдение, удаление не требуется). После 4 нед те же участники указали свой диагноз и решение о лечении на II уровне, которое включало дерматоскопические изображения, дополненные дополнительной клинической информацией и изображениями крупным планом тех же 100 случаев. Основными показателями результатов были чувствительность, специфичность и площадь под кривой (AUC) для диагностической классификации поражений с помощью ИИ по сравнению с оценками дерматологов.
На I уровне дерматологи достигли средней чувствительности и специфичности для классификации поражений 86,6±9,3 и 71,3±11,2% соответственно. Больше клинической информации (уровень II) повысило чувствительность до 88,9±9,6% (p=0,19) и специфичность до 75,7%±11,7% (p<0,05). Кривая ROC у CNN показала более высокую специфичность 82,5% по сравнению с дерматологами на I (71,3%, p<0,01) и II уровне (75,7%, p<0,01) при их чувствительности 86,6 и 88,9% соответственно. CNN ROC AUC была больше средней площади ROC-кривой дерматологов (0,86 против 0,79, p<0,01). Независимо от опыта врачей большинство дерматологов уступило ИИ.
В исследовании авторов M.A. Marchetti и соавт. сравнивали эффективность компьютерных алгоритмов в диагностике МК со средней эффективностью 8 опытных дерматологов, использующих 100 дерматоскопических изображений пигментных поражений. В результате было обнаружено, что отдельные компьютерные алгоритмы имеют диагностическую точность, сравнимую с оценкой дерматологом: при чувствительности 82% средняя специфичность была аналогично лучшему компьютерному алгоритму [51].
Нейросеть показала высокую эффективность (чувствительность >93,3%, специфичность >65%) при злокачественных лентиго и узловых МК [52].
Использование мобильных приложений и телемедицинских технологий
Кроме непосредственного применения, вышеизложенные подходы и методы реализуются в телемедицинских технологиях в виде приложений для смартфонов, которые используются пациентами и медицинскими работниками: они могут направить пациента за медицинской помощью, а врачам помогают решить, следует ли направить пациента к онкологу.
Телемедицинские технологии – это информационные технологии, обеспечивающие дистанционное взаимодействие медицинских работников между собой, с пациентами и (или) их законными представителями, идентификацию и аутентификацию указанных лиц, документирование совершаемых ими действий при проведении консилиумов, консультаций, дистанционного медицинского наблюдения за состоянием здоровья пациента, согласно Федеральному закону Российской Федерации от 29.07.2017 № 242-ФЗ «О внесении изменений в отдельные законодательные акты Российской Федерации по вопросам применения информационных технологий в сфере охраны здоровья»1.
Мобильная теледерматоскопия получила положительную оценку в отношении как непосредственного взаимодействия с пациентами, так и взаимодействия между врачами [53].
В исследовании «Предпочтения потребителей в отношении скрининга рака кожи с помощью мобильной теледерматоскопии» было проведено интервью, посвященное поведению людей при скрининге. Тематический анализ был проведен двумя независимыми исследователями. Всего опрошено 28 участников. 86% участников ранее проходили обследование кожи, 18% посещали одного и того же врача для каждого осмотра кожи. В результате 27 участников (96,4%, n=27/28) предпочли бы использование мобильной теледермоскопии для мониторинга повреждений кожи между плановыми визитами к врачу и 1 участник (3,6%, n=1/28) ответил, что он не уверен [53].
В проведенном обзоре мобильных приложений для выявления ЗНК отмечается, что с 2014 г. наблюдается устойчивый рост числа приложений, доступных для первичной и вторичной профилактики ЗНК. Однако количество приложений с доказательной эффективностью увеличилось незначительно, что может приводить к опасениям пользователей относительно эффективности этих приложений. Для обеспечения безопасности пользователей мобильные приложения должны быть более надежными и общедоступными.
Поиск приложений для профилактики ЗНК проводился в двух крупных магазинах приложений для смартфонов (Android и iOS) в июне 2019 г. Были описаны количество, функциональность, рейтинги, цена приложений и проведено сравнение с аналогичными обзорами рынка приложений с 2014 по 2017 г. Поиск в июне 2019 г. выявил 66 приложений. Из 39 приложений, обнаруженных в 2014 г., 30 были недоступны в 2019 г., что составляет 77%; из 43 приложений, доступных в 2017 г., следовательно, количество доступных приложений за указанный период снизилось и составило 46,5%. В 2019 г. увеличилось количество приложений, которых можно было загрузить бесплатно, 63,6% (n=42/66) по сравнению с 53,5% (n=23/43) в 2017 г. Наиболее распространенной функциональностью приложения, предлагаемой в 2019 г., был мониторинг/отслеживание поражений – 48,5% (n=32/66). С 2014 г. наблюдается неуклонный рост числа приложений, доступных для широкой публики для поддержки профилактики или раннего выявления ЗНК. По-прежнему наблюдается высокая текучесть приложений, многим приложениям по-прежнему не хватает информации доказательств их безопасности и ценности [54]. Примеры мобильных приложений доступных в 2023 г. представлены в табл. 1.
Таблица 1. 10 мобильных приложений для смартфонов, доступных в магазинах App Store и Play Market
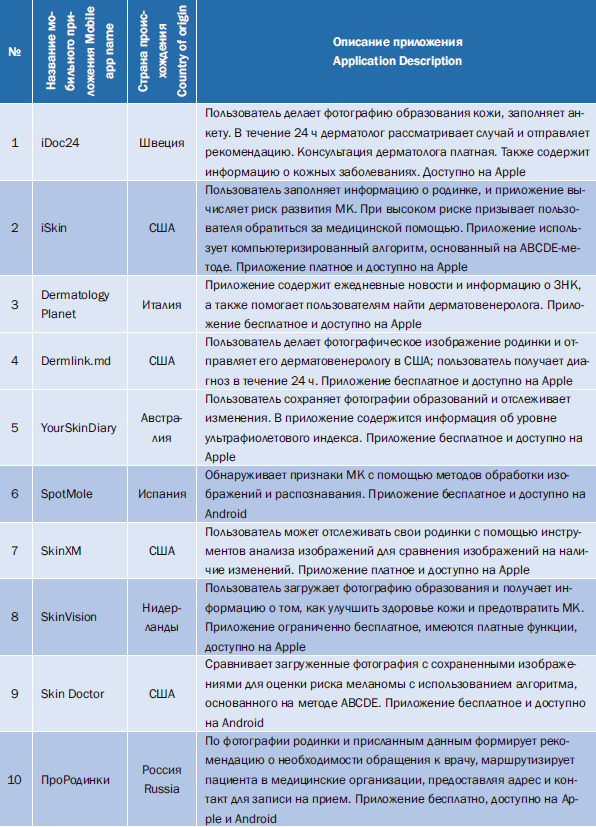
В Германии была проведена оценка мобильного приложения SkinVision (№ 8) для диагностики МК. Чувствительность диагностики составляла 73,0%, специфичность – 83,0% по сравнению с чувствительностью 88,0% и специфичностью 97,0% клинического диагноза дерматологами. Минусом в работе приложения является ограниченно бесплатное использование [55].
В России разработан программный комплекс «ПроРодинки» (№ 10) для использования пациентами и специалистами. Приложение доступно на смартфонах и предназначено для анализа НК по фотографии, а также набора риск-факторов, предоставленных пользователем. Фотографии, сделанные пользователями, проходят контроль с помощью алгоритмов компьютерного зрения [56]. Алгоритм определяет наличие и размеры новообразования на полученном снимке. Анализ полученных снимков выполняется с применением ансамбля нейронных сетей, обученного на верифицированном банке изображений риск-факторов и на динамике новообразований.
В исследовании, опубликованном в 2023 г., было обработано с помощью ИИ и проверено экспертами-дерматологами более 400 тыс. изображений, присланных пользователями в сочетании с факторами риска и демографическими данными. Алгоритмами приложения выявлено 9321 ЗНК, в том числе 5230 МК [57].
Результаты использования телемедицинских технологий в виде интернет-платформы для дистанционных консультаций сельского населения были опубликованы в работе P. Sall N’diaye и соавт. [58]. Проведен осмотр кожи у 289 человек, у 199 (69%) заподозрены ЗНК. Фотографии поражений кожи были переданы 4 дерматовенерологам для дистанционной консультации. В результате у 105 (53%) пациентов подозрение на ЗНК не подтвердилось и последующих очных консультаций не потребовалось. 61 (31%) пациент направлен к дерматовенерологу для осмотра в плановом порядке. 17 (9%) пациентов направлены на прием в экстренном порядке. 16 (8%) пациентам рекомендовано динамическое
наблюдение и консультация дерматовенеролога через 12 мес. Впоследствии из 78 пациентов, которым требовалась очная консультация дерматовенеролога, у 12 человек была заподозрена МК (по результатам биопсии подтверждена 1 МК), у 10 пациентов заподозрены ЗНК (во всех случаях по результатам биопсии подтверждены доброкачественные образования).
Таким образом, использование телемедицинских технологий может снижать необходимость очных осмотров дерматовенерологом.
В другом исследовании было показано, что использование телемедицинских технологий сокращает срок постановки диагноза у пациента с меланомой (среднее время между получением направления и обращением к онкологу составляет 9 дней по сравнению с 26,5 днями при стандартной амбулаторной помощи) [59].
Преимущества мобильных приложений для диагностики ЗНК в виде ориентированности на пациента, ускорения визитов к врачу, доступности, экономии времени, возможности контроля НК отмечается и другими авторами [60]. Эти же авторы указывают на ограничения применения мобильных приложений при поражениях кожи в труднодоступных местах, кроме того, сохраняется недоверие пользователей к телемедицинским технологиям в виде использования мобильных приложений.
Результаты и обсуждение
После поиска в достоверных научных базах статей по эффективности современных методов выявления ЗНК, включая использование мобильных приложений и ИИ, было проведено сравнение чувствительности методов. Несмотря на свое преимущество в относительной простоте использования, визуальные методы показывают невысокую чувствительность и специфичность (табл. 2). Методы ультразвуковой диагностики требуют соответствующее оборудование, приводя к росту расходов на диагностику, тем не менее тоже в некоторых случаях показывают сравнительно невысокую специфичность.Таблица 2. Чувствительность методов, используемых для диагностики злокачественных новообразований кожи
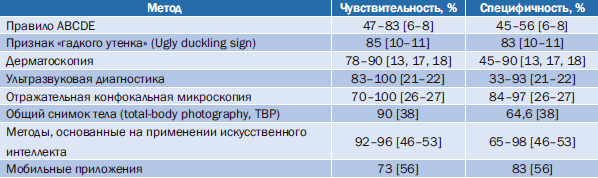
Наиболее широко используемый в клинической практике метод дерматоскопии требует соответствующей подготовки врачей, поскольку при использовании неподготовленными специалистами показывает точность не выше, чем при визуальном осмотре.
Из достижений последних лет можно отметить использование инструментов на основе ИИ. Исследования, построенные на анализе изображений ЗНК, показывают высокую чувствительность и специфичность (см. табл. 2). Полученные результаты могут внушать определенный оптимизм, но пока использование таких технологий в клинической практике относительно редко.
Использование мобильных приложений с применением нейронных сетей и приложений для самодиагностики пока находится в стадии поиска наиболее эффективных подходов, несмотря на то что в некоторых странах надзорные органы одобрили использование подобных решений в клинической практике, к тому же отмечается небольшое количество качественных исследований эффективности данных технологий. В определенных случаях использование приложений может приводить к росту расходов на здравоохранение [61].
Заключение
Поскольку в последние годы отмечается рост заболеваемости ЗНК [62], повышается нагрузка на систему здравоохранения, возникает необходимость в поиске и внедрении новых подходов. Наряду с уже традиционными методами широкой перспективой обладает поиск решений в области применение телемедицинских технологий, в частности в виде мобильных приложений с различными алгоритмами. Таким образом, поиск и исследование эффективных методов для выявления ЗНК становится одной из самых перспективных задач для исследователей на стыке различных научных дисциплин и областей знаний.1 Федеральный закон Российской Федерации от 29.07.2017 № 242-ФЗ «О внесении изменений в отдельные законодательные акты Российской Федерации по вопросам применения информационных технологий в сфере охраны здоровья».
СВЕДЕНИЯ ОБ АВТОРАХ
Сиводедова Наталья Антоновна (Natalia A. Sivodedova) – аспирант кафедры общественного здоровья и здравоохранения ФДПО, ФГБОУ ВО ПИМУ Минздрава России; врач-онколог, заведующий отделом телемедицины и информационных технологий, ГАУЗ НО НИИКО «Нижегородский областной клинический онкологический диспансер», Нижний Новгород, Российская Федерация
https://orcid.org/0000-0001-6815-328X
Карякин Николай Николаевич (Nikolay N. Karyakin) – доктор медицинских наук, доцент, ректор ФГБОУ ВО ПИМУ Минздрава России, Нижний Новгород, Российская Федерация
https://orcid.org/0000-0001-8958-6199
Шливко Ирена Леонидовна (Irena L. Shlivko) – доктор медицинских наук, заведующий кафедрой кожных и венерических болезней, ФГБОУ ВО ПИМУ Минздрава России, Нижний Новгород, Российская Федерация
https://orcid.org/0000-0001-7253-7091
 Высшая школа организации и управления здравоохранением
Высшая школа организации и управления здравоохранением