Вакцинация против COVID-19 не влияет на репродуктивное здоровье мужчин (по данным РНК-секвенирования)
Введение
В настоящее время во всем мире активно проводится вакцинация от COVID-19 с использованием недавно зарегистрированных вакцин. Однако влияние данных вакцин на репродуктивное здоровье мужчин на текущий момент не исследовано.
Ранее Общество по изучению репродуктивного здоровья мужчин (SSMR) опубликовало рекомендации совместно с Обществом по репродуктивному здоровью мужчин и урологии (SMRU), включающие следующие положения:
- не следует отказывать в проведении вакцинации против COVID-19 мужчинам, заинтересованным в реализации репродуктивной функции;
- вакцины против COVID-19 должны быть предложены в равной степени всем мужчинам, вне зависимости от их заинтересованности в реализации репродуктивной функции [1].
Результаты первого исследования, посвященного влиянию вакцины против COVID-19 на показатели спермограммы, было проведено Safrai М. и соавт., которые продемонстрировали отсутствие изменений в параметрах спермограммы после проведения вакцинации мРНК-вакциной BNT162b2 (Pfizer/BioNTech). В данное исследование были включены 43 мужчины, среди которых у 14 было диагностировано бесплодие, а у 29 наблюдались нормальные результаты спермограммы. Авторами было отмечено, что после вакцинации против COVID-19 ни один из показателей спермограммы существенным образом не изменился [2]. Несмотря на актуальность данного исследования, важно отметить, что статья Safrai M. и соавт. была опубликована в качестве препринта, что означает отсутствие независимого рецензирования экспертами. Более того, в статье не указан временной промежуток с момента вакцинации до проведения анализа эякулята.
Аналогичное исследование было проведено D.Gonzalez и соавт., которые провели анализ показателей спермограммы 45 мужчин репродуктивного возраста до проведения вакцинации против COVID-19 и через 70 дней после введения второго компонента мРНК-вакцины BNT162b2 (Pfizer-BioNTech) или mRNA-1273 (Moderna). Авторы не выявили выраженного изменения показателей спермограммы после проведения вакцинации против COVID-19. Стоит также отметить, что данные результаты были опубликованы в качестве "научного письма" (research letter) и не содержит подробных данных относительно проведенного исследования [3].
Материал и методы
Настоящее исследование было проведено на базе Городской клинической больницы №15 им. О.М. Филатова. В исследование были включены 10 мужчин в возрасте от 18 до 50 лет.
Для оценки влияния вакцины "Гам-КОВИД-Вак" ("Спутник V") на мужскую фертильность было проведено комплексное обследование, включающее анализ показателей спермограммы (параметры концентрации, подвижности, морфологии сперматозоидов; MAR-тест), клинического и биохимического анализов крови, оценка параметров гормонального профиля (общий тестостерон, эстрадиол, ФСГ, ЛГ, пролактин), выявление сопутствующих урологических заболеваний (сбор анамнеза, физикального обследования наружных половых органов и простаты). Результаты данного этапа исследования были опубликованы ранее [4].
Исследуемую группу составили 6 мужчин, планирующие проведение вакцинации от COVID-19 векторной вакциной "Гам-КОВИД-Вак" ("Спутник-V") Национального исследовательского центра эпидемиологии и микробиологии им. Н.Ф. Гамалеи. В группу сравнения были включены четверо мужчин, не заинтересованных в вакцинации от COVID-19.
Все пациенты, включенные в исследование, были четко инструктированы о сборе образцов эякулята в стерильный контейнер после не менее 48 часового и не более 5-7-дневного воздержания. Образцы эякулята пациентов исследуемой группы были получены до вакцинации и через 75 дней после введения второго компонента вакцины "Гам-КОВИД-Вак". Образцы эякулята пациентов группы сравнения были получены с аналогичным временным интервалом.
Выделение и секвенирование РНК
Выделение РНК из образцов эякулята проводилось с помощью универсального набора QIAGEN RNeasy Plus Universal Mini Kit в соответствии с протоколом производителя. Для измерения концентрации РНК использовали наборы RNA 6000 Nano и Qubit RNA Assay. Число целостности РНК (RIN) измеряли с помощью биоанализатора Agilent 2100. Для деплеции рибосомальной РНК и конструирования библиотек использовали набор KAPA RNA Hyper. Для мультиплексирования образцов в одном цикле секвенирования использовались разные адаптеры. Концентрация и качество библиотеки измерялись с помощью набора Qubit ds DNA HS Assay (Life Technologies) и Agilent TapeStation. Секвенирование РНК было выполнено с использованием оборудования Illumina NextSeq 550 в режиме одноконцевого прочтения, длина прочтения 75 п.н., получено примерно 30 миллионов сырых прочтений на образец. Демультиплексирование проводили с помощью программы Illumina Bcl2fastq2 v 2.17.
Биоинформатический анализ
Файлы FASTQ, полученные после секвенирования РНК, были обработаны с помощью программного обеспечения STAR в режиме GeneCounts с аннотацией транскриптома человека от Ensembl (версия сборки генома GRCh38 и аннотация транскриптов GRCh38.89). Идентификаторы генов Ensembl были преобразованы в символы генов HGNC с использованием полного набора данных HGNC (https://www.genenames.org/; версия базы данных от 13 июля 2017 г.). Уровни экспрессии были установлены для 36 596 аннотированных генов с соответствующими идентификаторами HGNC. Минимальное количество однозначно картированных прочтений составило 3,41 млн для исследуемых биопроб при среднем значении 15,95 млн. Анализ дифференциальной экспрессии генов выполняли с использованием программного обеспечения DESeq2 со следующими пороговыми значениями: скорректированное р-значение FDR <0,05 и | log2 (кратности изменения) | > 1. Дифференциальные гены визуализированы с помощью R пакета EnhancedVolcano.
Результаты
Мы выполнили секвенирование РНК (РНКсек) образцов спермы, полученных до и после вакцинации (n=6) или контрольных образцов, взятых с таким же временным интвервалом (n=4). Всего было получено 10 РНКсек профилей, статистика картирования представлена в табл. 1.
Таблица 1. Статистика картирования прочтений
| # | До/после вакцинации/контроля | РНКсек идентификатор | Уникально картированные прочтения, млн |
| 1 | До | 1-1_S1_ME_L001_R1_001 | 22.02 |
| 1 | После | 1-3_S2_ME_L001_R1_001 | 18.03 |
| 10 | До | 10-1_S10_ME_L001_R1_001 | 14.83 |
| 10 | После | 10-3_S11_ME_L001_R1_001 | 10.94 |
| 17 | До | 17-1_S3_ME_L001_R1_001 | 17.87 |
| 17 | После | 17-3_S4_ME_L001_R1_001 | 11.60 |
| 31 | До | 31-1_S9_ME_L001_R1_001 | 20.27 |
| 31 | После | 31-3_S10_ME_L001_R1_001 | 18.87 |
| 34 | До | 34-1_S12_ME_L001_R1_001 | 17.07 |
| 34 | После | 34-3_S13_ME_L001_R1_001 | 16.92 |
| 39 | До | 39-1_S16_ME_L001_R1_001 | 3.41 |
| 39 | После | 39-3_S17_ME_L001_R1_001 | 12.42 |
| 42 | До | 42-1_S5_ME_L001_R1_001 | 17.19 |
| 42 | После | 42-3_S6_ME_L001_R1_001 | 20.55 |
| 43 | До | 43-1_S14_ME_L001_R1_001 | 14.85 |
| 43 | После | 43-3_S15_ME_L001_R1_001 | 10.46 |
| 44 | До | 44-1_S11_ME_L001_R1_001 | 18.21 |
| 44 | После | 44-3_S12_ME_L001_R1_001 | 20.80 |
| 46 | До | 46-1_S18_ME_L001_R1_001 | 14.64 |
| 46 | После | 46-3_S13_ME_L001_R1_001 | 18.11 |
Далее был проведен кластерный анализ исследуемых образцов. Для этого были логарифмированы нормализованные количества прочтений генов при помощи программного обеспечения DESeq2. Полученная дендрограмма показана на рис. 1. Все пары образцов до/после сгруппированы вместе, за исключением двух вакцинированных пациентов: 39 и 46.
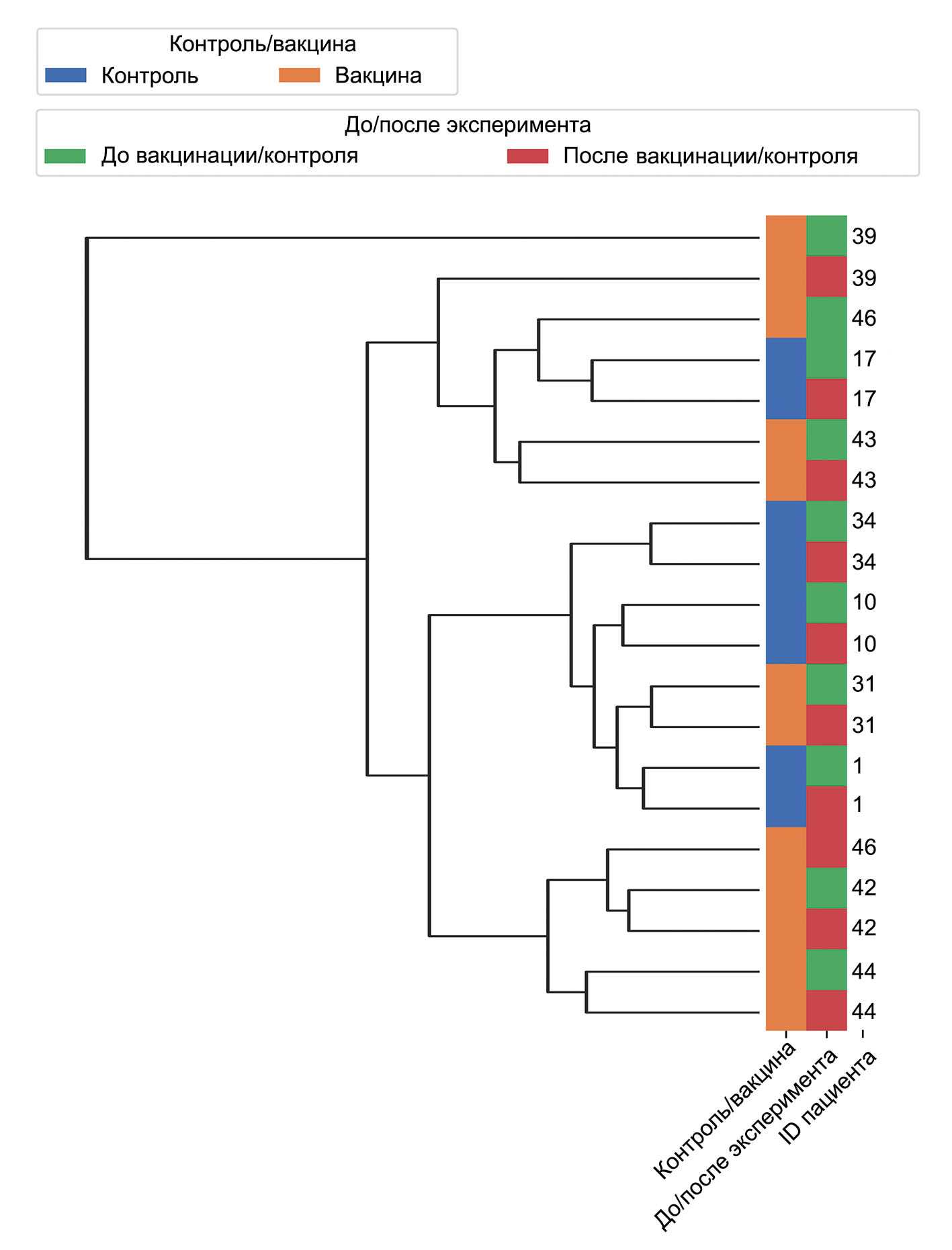
Рис. 1. Кластерный анализ логарифмированных значений нормализованной генной экспрессии. Образцы "до" и "после" показаны зеленым и красным цветом соответственно.
Также был выполнен анализ главных компонент (PCA) для данных генной экспрессии. Полученные результаты указывают на то, что расстояние между образцами, полученными до и после вакцинации, в среднем выше, чем в контрольной группе (рис. 2), что соответствует с кластерному анализу.
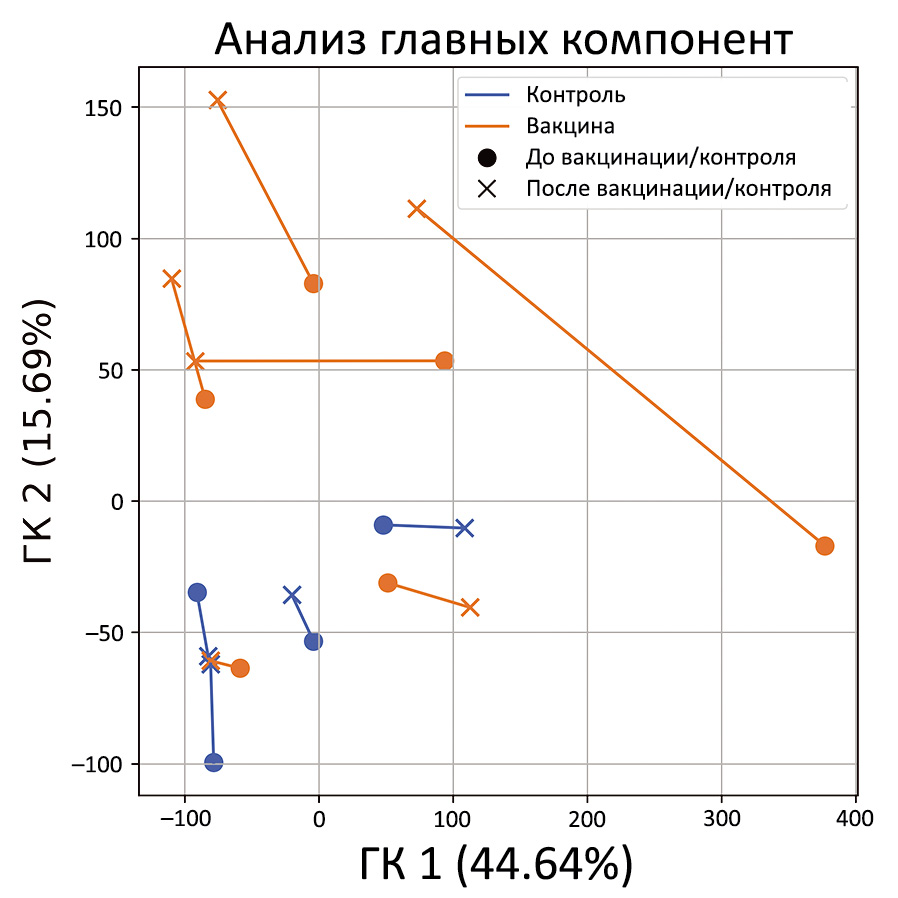
Рис. 2. Анализ главных компонент для логарифмированных значений нормализованной генной экспрессии. Пробы "до" и "после" соединяются линией для каждого пациента. Образцы группы контроля и мужчин, вакцинированных от COVID-19, показаны синим и оранжевым цветом соответственно.
На следующем этапе исследования был выполнен парный анализ дифференциальной экспрессии генов между образцами, полученными до и после вакцинации. В образцах, полученных после вакцинации, выявлено 13 статистически значимых дифференциальных генов с повышенной экспрессией: C2orf16, FAM153A, LINC01095, PRSS37, LINC01921, SPATA31D5P, DAB1-AS1, DDX4, MIR7515HG, CEP152, ENAM, FAM186A, SORCS3-AS1 (рис. 3). Не было выявлено статистически значимых терминов генной онтологии (GO), связанных с указанным набором генов. Также не было выявлено генов, экспрессия которых была бы значимо снижена после проведения вакцинации.
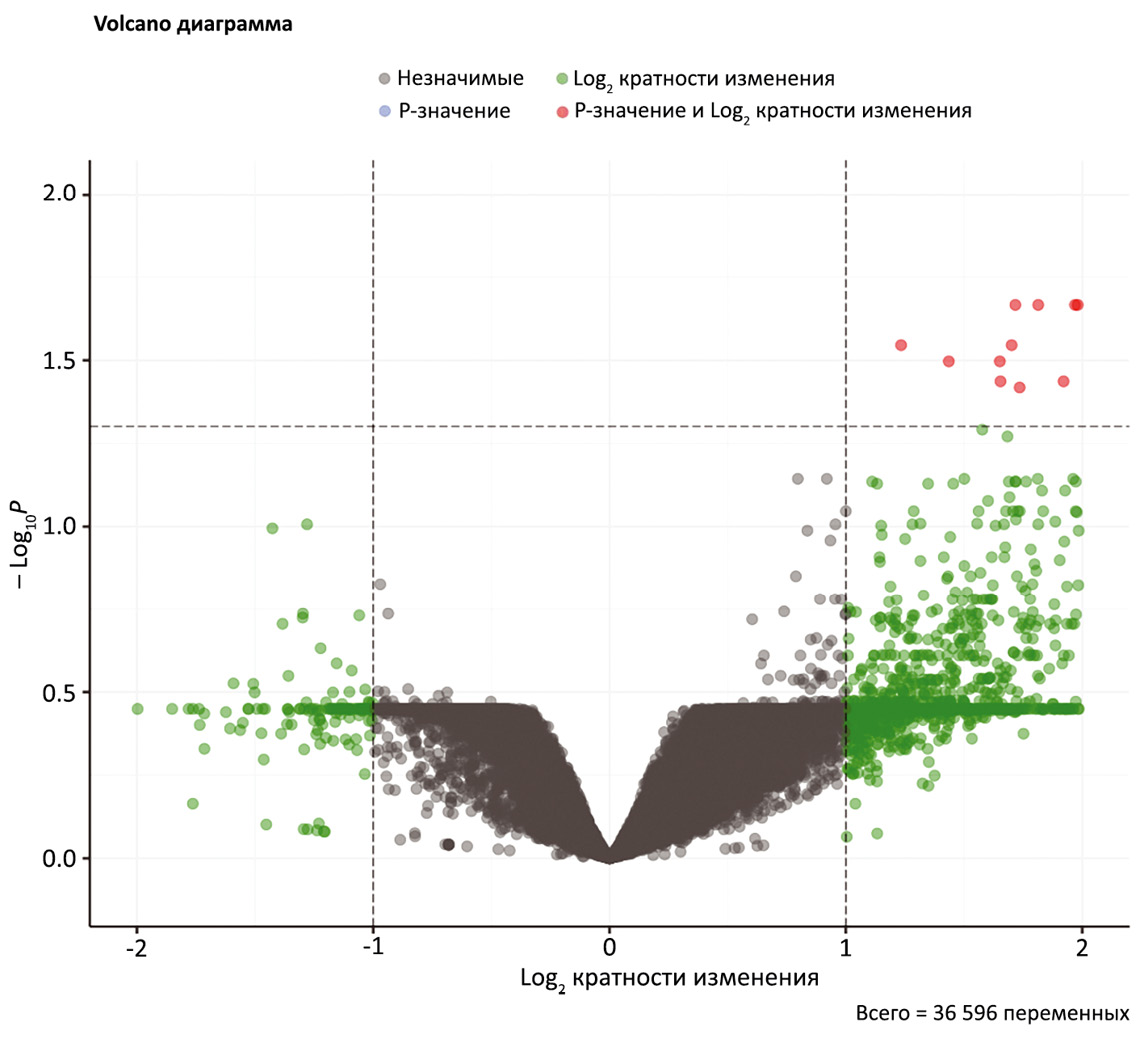
Рис. 3. Распределение дифференциальных генов по логарифму кратности изменения и логарифму p-значения между образцами пациентов 31, 39, 42, 43, 44 и 46, полученными до и после вакцинации. Порог FDR-корректированного p-значения - 0,05. Порог для модуля двоичного логарифма кратности изменения - 1.
Далее был проведен анализ дифференциальной экспрессии между контрольными образцами, взятыми с аналогичным временным интервалом. Статистически значимых дифференциально экспрессирующихся генов в результате данного анализа выявлено не было (рис. 4).
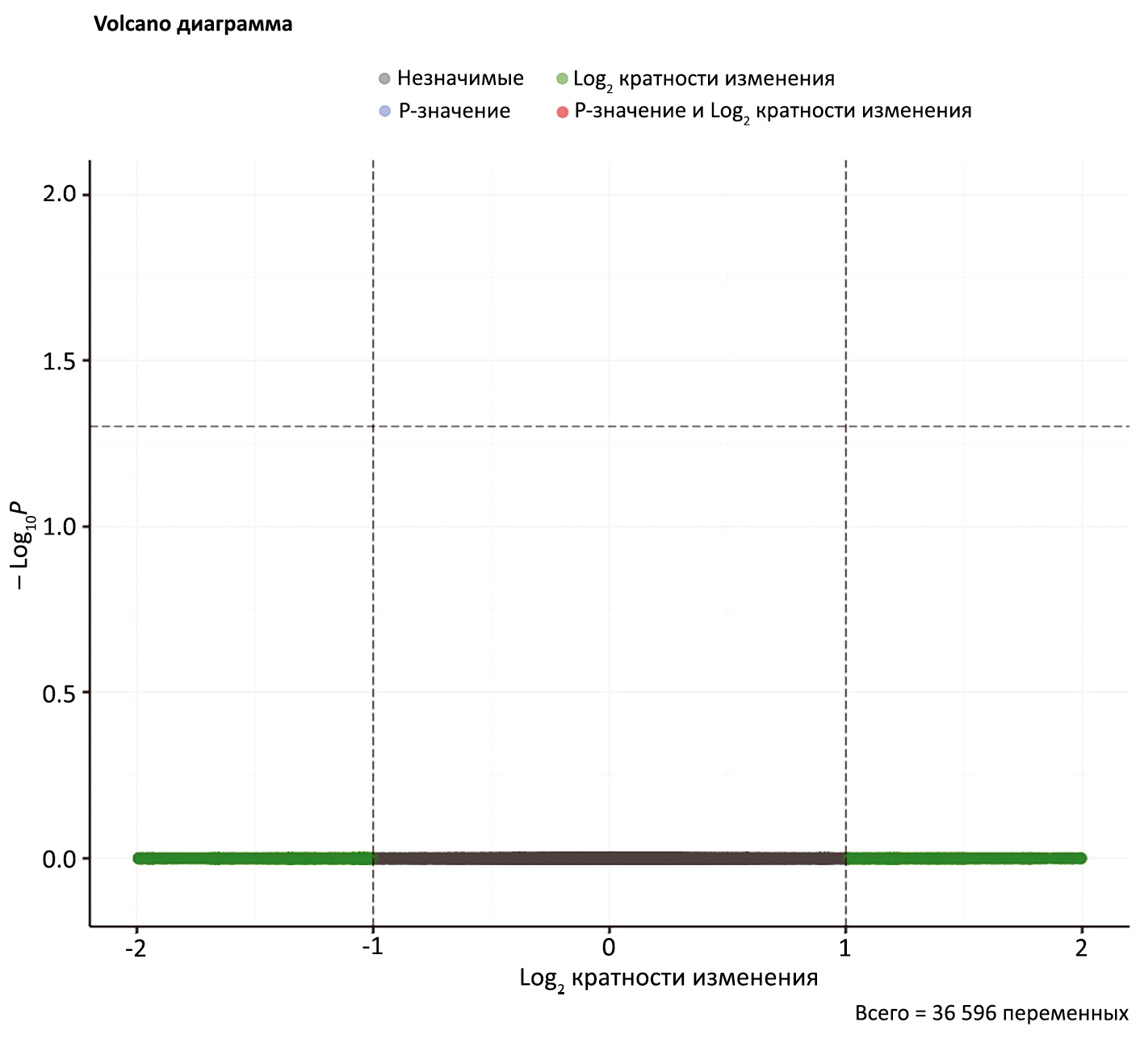
Рис. 4. Распределение дифференциальных генов по логарифму кратности изменения и логарифму p-значения между образцами пациентов 1, 10, 17 и 34, полученными для контрольных образцов, взятых с тем же временным интервалом, что и для вакцинированных пациентов. Порог FDR-корректированного p-значения - 0,05. Порог для модуля двоичного логарифма кратности изменения - 1.
Обсуждение
В данном исследовании был проведен сравнительный анализ образцов эякулята двух исследуемых групп мужчин репродуктивного возраста на уровне экспрессии генов. В исследуемой группе образцы эякулята были получены до вакцинации и через 75 дней после введения второго компонента вакцины, в группе сравнения образцы эякулята были получены с аналогичным временным интервалом. Не было обнаружено статистически значимо дифференциально экспрессирующихся генов в образцах эякулята мужчин группы сравнения. В то же время в результате сравнительного анализа образцов эякулята, полученных до и после вакцинации, было выявлено 13 генов, экспрессия которых достоверно повышена в образцах эякулята, полученных после вакцинации. Согласно базе данных Gene от NCBI и проекту Атлас Протеома Человека (HPA, https://doi.org/10.1074/mcp.M113.035600) 9 из данных 13 генов экспрессируются исключительно в семенниках: LINC01095, PRSS37, LINC01921, SPATA31D5P, DAB1-AS1, DDX4, MIR7515HG, SORCS3-AS1, FAM186A, а экспрессия генов FAM153A и CEP152 повышена в семенниках и ряде других тканей. Два гена из вышеуказанных кодируют длинные некодирующие РНК (LINC01095, LINC01921), 1 ген - микроРНК (MIR7515HG), 1 - псевдоген (SPATA31D5P), 2 - антисмысловую РНК (DAB1-AS1, SORCS3-AS1), 5 генов являются белок-кодирующими (PRSS37, DDX4, FAM153A, CEP152, FAM186A). Ген CEP152 кодирует центросомный белок [5], а функция генов FAM153A и FAM186A неизвестна. Ген DDX4 кодирует хеликазу, и ранее было показано, что метилирование данного гена (а, следовательно, и его пониженная экспрессия) остановкой созревания сперматозоидов [6]. Ген PRSS37, в свою очередь, кодирует сериновую протеазу, низкий уровень которой в образце эякулята по данным литературы ассоциирован с идиопатическим мужским бесплодием [7].
В ранее проведенном исследовании мы выявили, что в образцах эякулята, полученных после перенесенного COVID-19, снижена экспрессия митохондриальных генов и изменен уровень активации сигнальных путей Toll-подобных рецепторов [8]. Это потенциально может приводить к нарушению энергетического обмена в сперматозоидах и снижению их подвижности после перенесенного COVID-19. В данной же работе мы продемонстрировали результаты по повышению экспрессии 13 генов в образцах эякулята, полученных после проведения вакцинации от COVID-19. Интересно отметить, что по данным литературы сниженная экспрессия двух генов из вышеуказанных (DDX4 и PRSS37) ассоциирована с идиопатическим мужским бесплодием.
Заключение
Сравнительный анализ образцов эякулята, полученных до вакцинации против COVID-19 векторной вакциной "Гам-КОВИД-Вак" ("Спутник-V") и через 75 дней после введения второго компонента вакцины не выявил статистически значимых изменений в функционировании внутриклеточных молекулярных путей. Полученные данные позволяют предположить отсутствие негативного воздействия указанной вакцины на молекулярно-генетические характеристики сперматозоидов у мужчин репродуктивного возраста.
Для формирования финальных выводов об отдаленных последствиях вакцинации против COVID-19 на репродуктивное здоровье мужчин необходимо проведение дальнейших масштабных клинических исследований. Но полученные на данный момент результаты подтверждают безопасность вакцины "Гам-КОВИД-Вак" ("Спутник-V") и подчеркивают необходимость вакцинации, которая остается единственным эффективным методом профилактики новой коронавирусной инфекции COVID-19. Таким образом, следует рекомендовать вакцинацию против COVID-19 мужчинам репродуктивного возраста для нивелирования вероятности неблагоприятных последствий инфекции, включающих ухудшение параметров эякулята, и в целом влияния COVID-19 на наступление и течение беременности.
 Высшая школа организации и управления здравоохранением
Высшая школа организации и управления здравоохранением
